Acide chlorhydrique
(chlorure d'hydrogène).
Formule : HCL
(Cl = 97,23 %, H = 2,76 %)
Masse molaire = 36,461 ± 0,002
g·mol-1
Appelé jadis "esprit de sel" ou acide muriatique. C'est un
acide liquide incolore à odeur piquante. qui,
concentré, peut avoir un pH inférieur à 1, et
très corrosif.
L'acide chlorhydrique pur n'existe pas sur Terre à
l'état naturel. Cependant, c'est une espèce chimique
qui a été fréquemment utilisée dans
l'histoire depuis les débuts de la chimie (en
utilisant des sels en présence d'acide sulfurique,
l'alchimiste perse Jabir Ibn Hayyan découvrit l'acide
chlorhydrique à partir de chlorure de sodium, vers l'an
800).
Nota : HCl est le principal constituant des acides gastriques. Il est
donc présent dans l'estomac où il contribue à la
digestion des aliments.
Préparation.
Réaction du dichlore
gazeux Cl2 qui réagit avec le dihydrogène H2 en
léger excès, pour produire du chlorure
d'hydrogène gazeux HCL
(la réaction a lieu
dans un brûleur, vers 2000°C) .
Cl2 + H2 >>> 2 HCl gaz
Ce dernier est ensuite absorbé dans l'eau :
HCL + eau >>> HCl aqueux
D'autres procédés basés sur le même
principe « brûlent » du carbone (coke) ou du dioxyde
de soufre en présence de chlore et de vapeur d'eau :
C + 2Cl2 + 2H2O >>> 4 HCl + CO2
SO2 + Cl2 + 2H2O + >>> 2 HCl + H2SO4
Réaction entre acide sulfurique H2SO4
et chlorures Cl :
(réaction en 2 étapes avec le sel contenant le chlorure
mCl)
H2SO4 + mCl >>> mHSO4 + HCl
mHSO4 + mCl >>> m2SO4 + HCl
Nota :
La première réaction a lieu à 150 à 300
°C, alors que 2ème étape nécessite une
température d'environ 550 à 600 °C et un
excès de sel.
Les procédé Mannheim et Berlin utilisent cette voie de
synthèse.
Caractéristiques principales
:
Les propriétés physiques de l'acide chlorhydrique,
telles que les points d'ébullition ou de fusion,
dépendent de la concentration (ou de la molarité d'HCl
en solution aqueuse). Elles varient depuis les
propriétés physiques de l'eau pour 0 % de HCl
jusqu'à celles de l'acide chlorhydrique fumant pour des
fractions supérieures à 40 % de HCl.
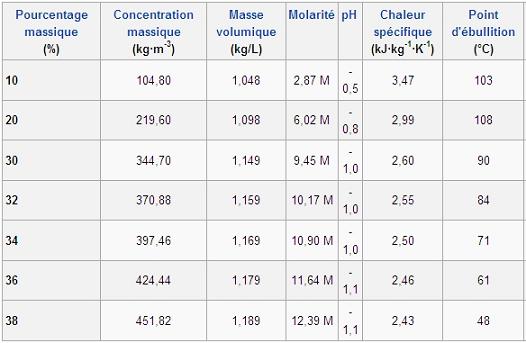
Température et pression de référence pour les
valeurs données : 20 °C et 1 atmosphère (1013
hPa).
Solutions commerciales :
- 10 à 12% (masse volumique : environ 1 048 kg/m3)
- 30 à 34% (masse volumique : 1 149 à 1 169
kg/m3)
Dans le traitement des eaux, il s’utilise par injection dans
l’eau sous forme de solutions commerciales diluées.
Formulation dans le traitement de l'eau.
Mécanisme réactionnel sur les bicarbonates
de calcium (équations simplifiées) :
...........................HCL +
Ca[HCO3]2
...>>> ....2 CO2
...+
...2H2O + CaCl2
.......................73.......162
ou
10°..............(2x44=88)
........................111
Par mg/l (ou g/m3) de HCl ajouté il
y a donc (10/73) = 0.137°F de baisse de
TAC, et il est formé (88/73)=1.205 mg de CO2 libre et
(71/111)= 0.64 mg/l de chlorures Cl.
Stockage.
Bien fermé et à l'abri de l'humidité, dans un
endroit bien ventilé.
Pour le stockage courant : pas de récipients
métalliques.
Utilisations.
- traitement des eaux (potables, usées et industrielles)
et traitements de piscines
- nettoyant domestique
- utilisé dans un grand nombre de procédés
industriels, dont :
- construction
- traitement du cuir
- fabrication d'engrais
- production de pétrole
- décapage et détartrage des métaux
- production de composés inorganiques
- régénération de résines
échangeuses d'ions
- fabrication de chlorures et de sels métallique
divers
- production d'ingrédients alimentaires ou d'additifs
alimentaires
Sécurité.
- Inhalation : les vapeurs peuvent être mortelles
- Ingestion : toxique, parfois mortel
- Peau : peut provoquer de graves blessures
- Yeux : très dangereux
 (utilisez votre navigateur)
(utilisez votre navigateur)

 (utilisez votre navigateur)
(utilisez votre navigateur)