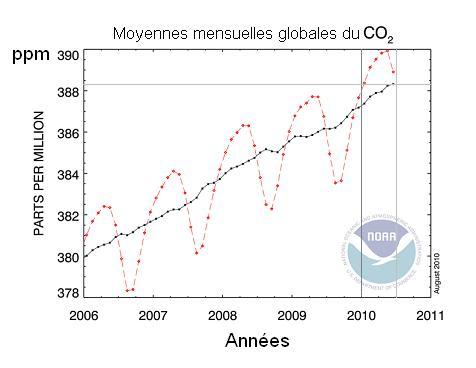
(source NOAA, mesure globales du CO2 sur la décennie)
GENERALITES :
Le dioxyde de carbone est le résultat de la combinaison de
deux éléments : un atome de carbone C et deux
atomes d'oxygène O, soit CO2 (ou
O=C=O). Masse molaire 44,01 g
mol-1.
Il est produit par différents processus : notamment lors de la
fermentation aérobie ou de la combustion de composés
organiques, et lors de la respiration des êtres vivants et des
végétaux. Pour ces derniers, la photosynthèse
piège beaucoup plus de CO2 que sa respiration n'en
produit.
On le trouve en faible proportion dans l'air atmosphèrique ou
il est assimilé par les plantes qui, à leur tour,
produisent de l'oxygène. Il y est présent dans une
proportion approximativement égale à 0,0389 % en volume
pour cette décennie (OMM, mi_2010),
soit 389 ppmv (parties par million en volume)
ou 591 ppm (massique). Mais elle augmente
rapidement, d'environ 1,43 ppmv/an, de par les activités
humaines de consommation des combustibles fossiles : charbon,
pétrole, gaz.

VALEURS DE LA PRESSION PARTIELLE DE CO2 :
Dans l'atmosphère, elle était à la fin des
années 1970 de 2.10-4 atm, et vingt ans plus tard,
du fait de l'évolution des activités humaines elle est
en moyenne de 3,4.10-4 atm, et actuellement de
3,89.10-4 atm (0,394 hPa).
C'est un gaz à effet de serre (GES,
voir ici
sur le site Hydro-Land) dont la
contribution relative à ce phénomène serait de
49 % (le méthane CH4 de
18 %).
Propriétés.
Le CO2 gazeux a une odeur très
légèrement irritante, il est incolore et plus lourd que
l'air.
En solution aqueuse, il forme l'acide carbonique
H2CO3 ( H2O +
CO2 <==> H2CO3
) qui est trop instable pour pouvoir être isolé
facilement.
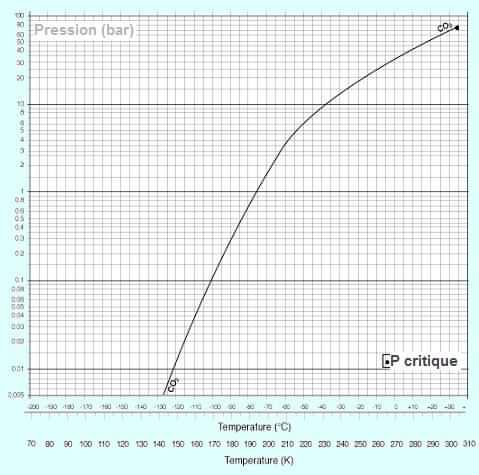
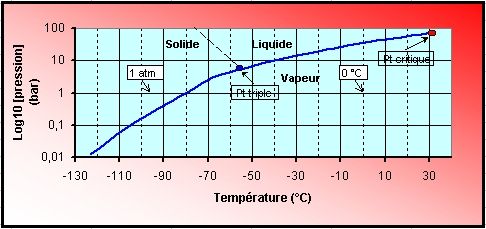
Le diagramme des phases du dioxyde de carbone
(CO2,
anhydride ou gaz carbonique) ci-dessous, montre que,
contrairement à l'eau, la courbe solide (glace
carbonique) et liquide
(CO2
liquide) présente une pente positive : la glace de
CO2 est plus dense que le gaz
liquéfié.
Nota : Masse volumique de la phase liquide
(à -20 °C et 19,7
bar) : 1032 kg/m3 et Masse volumique du solide
: 1562 kg/m3.
Seul gaz présent sous quatre formes : solide, liquide,
gazeuse et supercritique.
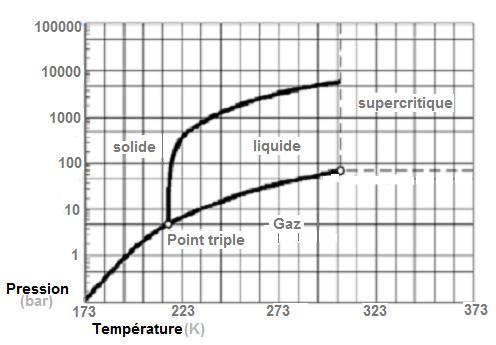
Par ailleurs, le point triple ( Température = -56,6 °C
(216,5 K) et Pression : 5180 hPa [5,18
bar] ) est supérieur à la pression
atmosphérique "normale" de 1013,25 hPa (1,013
bar), ainsi donc le CO2 liquide
ne peut exister à cette pression (il ne peut
donc fondre, ni bouillir à cette pression), par contre
il peut se sublimer a toutes pressions inférieures.
Le Point Critique se situe à Pc = 7,375 MPa (
73,75 bar ) et Tc = 30,95 °C
[304,1 K] .
Le CO2 solide est appelé
glace sèche (car elle ne fond pas, elle se sublime). A
noter qu'à 1 atm, la température de sublimation de
cette glace sèche est de -78,2 °C (194,95
K). Le CO2 se transporte habituellement
à l'état liquide dans des cylindres d'acier sous
pression (- 20°C et 20 bar).
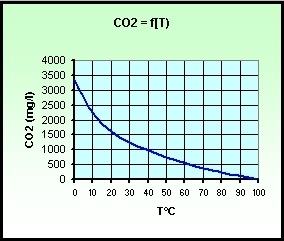
Solubilité du gaz dans l'eau
(à TPN >1013 hPa et 0 °C) : 1,7
vol/vol.
> solubilité en gramme par litre, en fonction de la
température (sous TPN) :
Nota - l'équilibre :
est réglé par la constante de Henry dont la valeur est (1013 hPa et 25 °C) :
avec
pCO2 : pression
partielle de CO2 et
[H2CO3]
: activité.
- Cette constante varie avec la température suivant
l'expression empirique :
avec t, température en ° Celsius.
- Notons que l'activité [H2CO3] représente
la molécule H2CO3 vraie (acide
carbonique) et le CO2 dissous moléculaire
présent à l'état de microbulles.
Par conséquent par exemple, dans une eau de surface à
25°C, on aura :
soit environ 0,53 g de CO2 libre par kg
d'eau pure, ou 0,53 mg/litre.
Quelques caractéristiques :
et sous forme solide ou glace carbonique (appelée aussi Carboglace ou glace sèche). Cette glace carbonique se sublime en ne laissant aucun résidu et produit très rapidement une grande quantité de froid (150 fr/h/kg à -78,5 °C), l'homme lui a donc rapidement trouvé de multiples utilisations :
Comme l'eau, au delà de son point critique
(voir plus haut), le dioxyde de carbone entre
dans une phase appelée "supercritique".
La courbe d'équilibre liquide gaz est interrompue au niveau du
point critique, assurant à la phase supercritique un continuum
des propriétés physico-chimiques sans changement de
phase. C'est une phase aussi dense qu'un liquide mais assurant des
propriétés de transport (viscosité, diffusion)
proche d'un gaz. Le dioxyde de carbone supercritique est
utilisée comme solvant "vert", les extraits étant
exempt de trace de solvant :
Applications industrielles.
Pâtes et papiers
Le dioxyde de carbone de réguler finement le pH des
pâtes recyclées, mécaniques ou chimiques
après un blanchiment alcalin. Il peut être
également utilisé dans la neutralisation du "tall oil"
et pour l'amélioration du fonctionnement des machines à
papier.
Industrie chimique
Le dioxyde de carbone est utilisé en chimie de
synthèse ou pour le contrôle de la température
des réacteurs. Le CO2 est également mis en œuvre
pour la neutralisation des effluents alcalins.
Il est utilisé sous des conditions supercritiques pour
réaliser des purifications ou des opérations de
teintures de fibres polymères ou végétales ou
animales.
Industrie pharmaceutique
Le dioxyde de carbone est utilisé pour l'inertage, la
synthèse chimique, l'extraction en phase supercritique (SFE),
la neutralisation (pH) des effluents aqueux ou le transport de
produits à basse température
(-78 °C or -108 °F).
Alimentaire et boissons
Le CO2 est utilisé dans le secteur alimentaire dans ces
principaux domaines :
Santé
Le CO2 produit une atmosphère proches des conditions
physiologiques lors de la manipulation d'organes artificiels.
Il est utilisé en mélange avec l'air ou
l'oxygène pour doper la respiration.
Il sert aussi pour la dilatation chirurgicale par insufflation
intra-abdominale.
Industrie des métaux
Le dioxyde de carbone est généralement utilisé
pour la protection de l'environnement :
Laboratoires et analyses
Le CO2 est la phase mobile dans des procédés
d'extraction ou de chromatographie en phase supercritique.
Électronique
Le dioxyde de carbone est généralement
employé dans le traitement des eaux usées ou en tant
que milieu de refroidissement durant les essais climatiques des
composants électroniques.
Il peut servir à augmenter la conductivité de l'eau
ultra-pure ou pour le nettoyage abrasifs de pièces sous forme
de neige carbonique et dans le procédé propre de
nettoyage des résines photosensibles au CO2 supercritique afin
d'éviter l'utilisation de solvants organiques.
Environnement
L'injection de dioxyde de carbone permet de maîtriser le pH des
effluents aqueux. Le CO2 est une excellente alternative au
contrôle du pH par l'acide sulfurique.
Autres industries
Neige carbonique pour extincteurs.
Contrôle et régulation du pH des eaux usées,
piscines, etc
MODE D'APPROVISIONNEMENT :
Le dioxyde de carbone peut être distribué :
Risques majeurs :
Lien
(canadien) sur les effets du CO2 sur la santé.
FICHE TOXICOLOGIQUE (INRS) :
fichier pdf à
télécharger éventuellement (71 ko).
>>> Site du BRGM (captage/stockage
du CO2).
 (utiliser votre
navigateur)
(utiliser votre
navigateur)