Acide nitrique.
Formule : HNO3
(O= 76,17 %, N= 22,23 %, H= 1,6 %)
Masse molaire = 63,0128 ± 0,0012
g·mol-1
C'est un acide monofonctionnel (monoacide) important en chimie
inorganique. Il s'agit d'un acide minéral, appelé
quelquefois acide azotique.
L'acide nitrique entre dans la composition des
pluies acides, où il se forme par
hydratation du dioxyde d'azote NO2, un polluant
atmosphérique important :
3 NO2 + H2O >>> 2
HNO3 + NO
Préparation.
La production commerciale de l’acide nitrique est faite
principalement par le procédé
Ostwald, et se réalise en 3 étapes à
partir de l’ammoniac NH3 :
- En premier, l’ammoniac est oxydé en
présence d’un catalyseur comme le platine
rhodié, pour former du monoxyde d’azote (NO)
(étape fortement exothermique),
- Puis le monoxyde d’azote est oxydé par
l’oxygène (O2) et produit du dioxyde
d’azote (NO2),
- Enfin, le dioxyde d’azote est dissous dans l’eau
pour produire l’acide nitrique dilué.
Le monoxyde d’azote produit est recyclé, et
l’acide nitrique est concentrée par distillation
jusqu’à un maximum de 68 %
(azéotrope du mélange acide nitrique -
eau). Les concentrations plus élevées sont
atteintes par traitement au nitrate de magnésium
(Mg(NO3)2). Globalement, ce
procédé permet d’atteindre un rendement de 96
%.
La production mondiale annuelle d’acide nitrique (par
différents procédés) est de l’ordre de 60
millions de tonnes.
Caractéristiques principales
:
Pur, c'est un liquide incolore et inodore. Diverses
impuretés le colorent souvent en jaune brun. À
température ambiante, il libère des fumées
rouges ou jaunes, du fait de sa décomposition partielle en
dioxyde d’azote sous l’effet de la lumière.
En solution aqueuse, il se dissocie complètement en un ion
nitrate NO3- et un proton
hydraté (cation hydronium
H3O+). Les sels de l’acide
nitrique, qui contiennent l’anion nitrate
NO3-, sont appelés des nitrates qui sont
très solubles dans l’eau. L’acide nitrique et ses
sels ne doivent pas être confondus avec l’acide nitreux
HNO2 et ses sels, les nitrites, qui contiennent l'anion
nitrite NO2-. Il est un agent oxydant
puissant
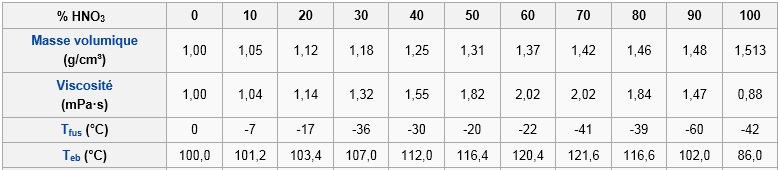
Propriétés (à 20 °C et 1,013 bar)
:
Liquide incolore lorsqu'il est pur, il s'agit d'un acide fort
(pKa = -1,37) généralement utilisé en solution
aqueuse, il était jadis appelée « eau-forte »
par les alchimistes puis les graveurs sur cuivre.
Mélangé avec l'acide
chlorhydrique, il forme l'eau
régale, l'un des rares réactifs capables de
dissoudre l'or et le platine.
Solutions commerciales.
Les solutions commerciales comprennent
généralement entre 52 % et 68 % d’acide nitrique.
Quand la solution comprend plus de 86 % d’acide nitrique, il est
dit « fumant » et existe en deux variétés :
blanche et rouge.
Dans le traitement des eaux, il s’utilise par injection dans
l’eau sous forme de réactif dilué (solutions).
Formulation dans le traitement de l'eau.
Mécanisme réactionnel sur les bicarbonates
de calcium (équations simplifiées) :
.....................
...................HNO3
+.....Ca[HCO3]2
.
......>>>.... .....
2CO2 ....+
H2O. +
Ca[NO3]2
.................(63)............
(162 ou
10°F)
...........................(44x2)
.......
Par mg/l (ou g/m3) de HNO3 ajouté il
y a donc (10/63) = 0.15°F de baisse de
TAC, et il est formé 1.396 mg de CO2 libre et 1.58 mg/l de
NO3.
Stockage.
S'effectue dans des récipients en acier inxoydables ou en
amuminium pour les teneurs supérieures à 80%.
Récipients en verre pour des petits volumes.
Matériaux non-compatibles : nichel, cuivre.
Utilisations :
- traitement des eaux usées ou
industrielles (sous forme de solutions aqueuses
diluées)
- très utilisé en métallurgie et en
microélectronique
- utilisé pour fabriquer par synthèse chimique des
engrais comme le nitrate d’ammonium NH4NO3
(75 % de la production d'acide nitrique est utilisée dans
la fabrication d’engrais azotés).
- utilisé à faible dose avec les décapants
industriels
- réactif de laboratoire, notamment pour des
réactions de nitration de composés organiques.
L'acide nitrique dilué chaud oxyde la fonction alcool
primaire des aldoses ou des acides aldoniques en acides
carboxyliques. On obtient ainsi des acides dicarboxyliques
nommées acides aldariques.
- On obtient la nitroglycérine en le mélangeant
avec de la glycérine
Sécurité.
Peut provoquer de graves brûlures. L’inhalation
des vapeurs peut entraîner un œdème pulmonaire. Au
contact d’acide nitrique concentré, la peau humaine se
teint en jaune du fait de réactions avec la kératine.
C’est un composé modérément toxique avec
une dose létale de 430 mg·kg-1.
Oxydant puissant, il réagit vivement avec les
réducteurs et les matières combustibles pouvant
occasionner des explosions.
Fiche toxicologique - Acide nitrique (FT
9) par l'Institut national de recherche et de
sécurité (INRS).
 (utilisez votre navigateur)
(utilisez votre navigateur)
 (utilisez votre navigateur)
(utilisez votre navigateur)