Acide acétique.
Formule brute : C2H4O2 - Formule
dévelopée : CH3-COOH
(O = 53,29 %, C = 40 %, H = 6,71 %)
Masse molaire = 60,052 ± 0,0025
g·mol-1
Il aussi connu sous le nom d'acide acétique glacial, acide
éthanoïque ou acide éthylique C'est un des plus
simples des acides carboxyliques (exemples : acide
méthanoïque, acide formique -sécrété
par certaines fourmis-, acide propanoïque, acide
propionique, acide butanoïque, etc.).
Son acidité vient de sa capacité à perdre le
proton de sa fonction carboxylique, le transformant ainsi en ion
acétate CH3COO-.
Il est naturellement présent dans le vinaigre
(il en contient typiquement entre 4 et 12 %), il lui donne son
goût acide et son odeur piquante
(détectable à partir de 1
ppm).
L'acide acétique est aussi présent dans
l'environnement. De nombreux végétaux en contiennent et
peuvent ainsi en dégager sous forme d'émission
volatile. La dégradation thermique du bois en produit. On le
trouve dans plusieurs aliments comme ingrédient ajouté
ou comme constituant naturel. L'activité humaine peut
être aussi source d'émission d'acide acétique
dans l'atmosphère, dont entre autres, les gaz
d'échappement des véhicules et la combustion de
végétaux, de plastiques ou d'autres déchets.
Préparation.
Industriellement, il est produit 75 % de l’acide
acétique destiné à l’industrie chimique par
carbonylation du méthanol. Egalement par oxydation de
l’acétaldéhyde ou par l'oxydation en phase liquide
du n-butane C4H10, ou bien il est
récupéré dans la production d'acétate de
cellulose ou d'alcool polyvinylique
(CH2- CHOH)n.
Il peut être préparé à partir de
l’éthylène (procèdésWacker ou de
Showa Denko). L’acide acétique peut être aussi
produit de façon synthétique ou par fermentation
bactérienne. Aujourd’hui, la méthode biologique ne
concerne plus que 10 % de la production, mais elle demeure importante
pour la fabrication de vinaigre car, dans la plupart des pays, la loi
dispose que le vinaigre à usage alimentaire doit être
d’origine biologique.
La demande mondiale annuelle d’acide acétique
(par différents procédés)
est d’environ 6,5 millions de tonnes par an.
Caractéristiques principales
:
L'acide acétique pur est un liquide incolore, inflammable,
hygroscopique, et très faiblement conducteur.
Ces propriétés de solvant et la miscibilité de
l’acide font qu’il est largement utilisé dans
l’industrie chimique.
Propriétés :
Cest un acide faible, monoprotonique en solution aqueuse, avec un
pKa d’environ 4,8 à 25 °C.
Il est corrosif pour de nombreux métaux, notamment le fer, le
magnésium et le zinc. Il forme du dihydrogène et des
sels de métaux appelés acétates.
L’aluminium forme au contact de l’oxygène une fine
couche d’oxyde d'aluminium relativement résistante, qui
recouvre sa surface : les réservoirs d’aluminium sont
souvent utilisés pour transporter l’acide
acétique.
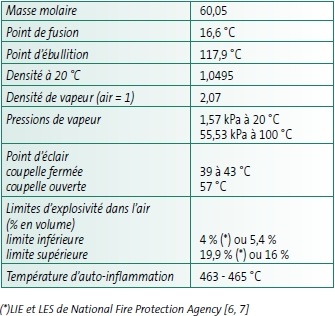
(à 25°C et sous 1013 hPa)
Solutions commerciales.
- en solution aqueuse de 3 à 10 % (poids/poids ou
P/P)
- en solution aqueuse à plus de 10 et moins de 80 %
(P/P)
- en solution aqueuse à plus de 80 % (P/P)
Dans le traitement des eaux, il s’utilise par injection dans
l’eau sous forme de réactif dilué
(solutions dilué à 5% en volume,
à partir de l'acide à 75%).
NOTA : Les impuretés qu'on peut détecter dans les
solutions d'acide acétique dépendent du
procédé utilisé pour produire l'acide
acétique glacial. On peut y détecter de petites
quantités d'acétaldéhyde, d'anhydride
acétique, d'acide formique, de diacétyle,
d'acétate de méthyle, d'acétoacétate
d'éthyle, de fer, de mercure, d'iode, de brome et de
chlorures.
Formulation dans le traitement de l'eau.
Mécanisme réactionnel sur les bicarbonates
de calcium (équations simplifiées) :
.....................
...................2CH3COOH
+.....Ca[HCO3]2
.
......>>>.... .....
2CO2 ....+
2H2O. +
Ca[CH3COO]2
.................(60x2)............
(162 ou
10°F)
...........................(44x2)
.......
Pour 1 mg/l (ou 1 g/m3) de
CH3COOH ajouté il y a donc
(10/120) = 0.08°F de baisse de TAC, et il
est formé 0.74 mg de CO2 libre et 0.98 mg/l d'acétate
CH3COO-.
Stockage.
Le choix d'un type de contenant doit être conforme au code des
liquides inflammables et combustibles, la capacité maximale
admissible des contenants et citernes portables pour les liquides
inflammables ou combustibles étant différente selon le
type de contenant..
A entreposer (lien)
dans un récipient hermétique, tenu fermé,
portant une identification claire de son contenu, placé dans
un endroit frais, sec et bien ventilé, à l'écart
des bases et des autres produits incompatibles. Entreposer dans un
endroit avec sol cimenté résistant à la
corrosion. Les réservoirs et les cuves de liquide corrosif
doivent être munis d'un dispositif anti-débordement.
Généralement stocké en récipients en
acier inoxydable ou en polyéthylène
haute-densité et polypropylène.
Utilisations :
- Traitement des eaux usées ou
industrielles (sous forme de solutions aqueuses
diluées)
- Comme solvant : miscible à l'eau et à divers
solvants organiques tels qu'éthanol, oxyde de
diéthyle, glycérol19 mais insoluble dans le sulfure
de carbone19, c'est aussi un bon solvant des gommes,
résines, du phosphore, du soufre et d'acides
halogénés19
- Production d'anhydride acétique, acétate de
cellulose, d'acétate de vinyle monomère, et d'autres
acétates, ainsi que de médicaments, pesticides,
colorants, produits de l'industrie de la photographie
- Alimentation (production de vinaigres de fruit, etc), additif
alimentaire
- Agent de nettoyage (de semi-conducteurs)
- Coagulant (du latex nature)
- Bactériostatique (en solution)
- Fabrication de plastiques tel que le
polyéthylène téréphtalate (PET) ou
l'acétate de cellulose, utile à la production
d'acétate de vinyle (peintures, adhésifs) et de
solvants organiques.
- Additif dans les produits dérivés du tabac
(arôme).
Sécurité.
 (utilisez votre navigateur)
(utilisez votre navigateur)

 (utilisez votre navigateur)
(utilisez votre navigateur)